Nano Lett.:集成电穿孔触发的细胞内记录与递送效率评估的心脏细胞生物传感平台
近日,胡宁课题组在细胞电生理学及细胞递送领域取得新进展,成果发表在国际顶级期刊Nano Letters,标题为“Integrated Cardiomyocyte-Based Biosensing Platform for Electroporation-Triggered Intracellular Recording in Parallel with Delivery Efficiency Evaluation”。该论文第一作者为博士研究生方佳如,胡宁研究员为通讯作者,刘川教授、黎洪波博士为共同通讯作者。
电穿孔是一种已被证实的技术,它可以记录心肌细胞的动作电位,并通过诱导细胞膜上纳米孔的产生来实现生物分子递送。然而,施加于心肌细胞的高电压仍然是一个挑战,使其能够安全有效地进入细胞内。为了保证细胞的活性,研究中经常使用与低压电穿孔配合的微纳米器件,而细胞内递送的有效性通常使用光学成像方法,如流式细胞术来评估。然而,这些复杂的分析方法阻碍了原位生物医学研究的效率。因此,有必要建议一个新的平台来实现安全有效的细胞内记录和体外原代心肌细胞递送评估。
在本工作中,我们设计了一个基于心肌细胞的生物传感平台,可用于原代大鼠心肌细胞的动作电位记录和递送评估。该平台由透明的ITO(铟锡氧化物)-MEA(多电极阵列)器件、自主研发的电穿孔-细胞内记录系统和图像采集处理系统组成,用于执行电穿孔触发的细胞内记录和递送效率评估。我们在ITO-MEA器件上设计了有效电极面积来感知动作电位,器件的透明度便于荧光图像采集。该自主研发的系统结合ITO-MEA装置,可通过电穿孔触发诱导细胞膜纳米孔的产生,有助于探索最优电穿孔条件。集成图像采集处理系统可有效分析心肌细胞的活力、递送效率和死亡率,以评估不同电穿孔条件下的电穿孔质量。
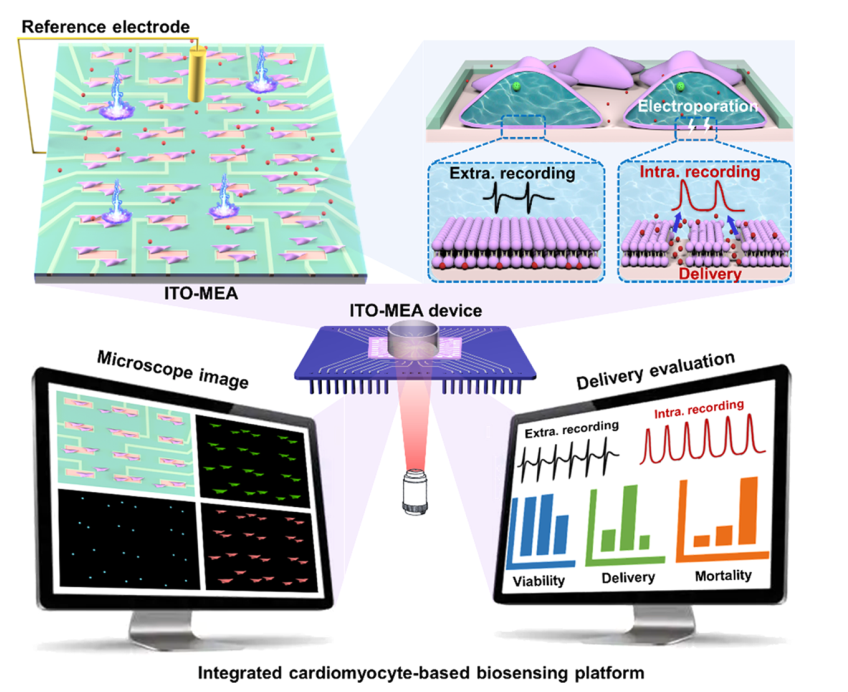
图一. 本工作所搭建的基于心肌细胞的生物传感平台。
我们通过微加工工艺制备了ITO-MEA电极。首先,电极、轨迹和垫片通过标准的光刻\ITO溅射和发射工艺在玻璃上刻印。随后,用SU-8对轨迹和有效电极区域进行图案化和绝缘,然后通过光刻技术在ITO层上图案化。ITO-MEA芯片包括32组电极、导线和垫片,其有效电极面积为电极中心200 μm × 50 μm的矩形,该器件可以与自行研制的动作电位记录和电控制系统相连接,如图二所示。
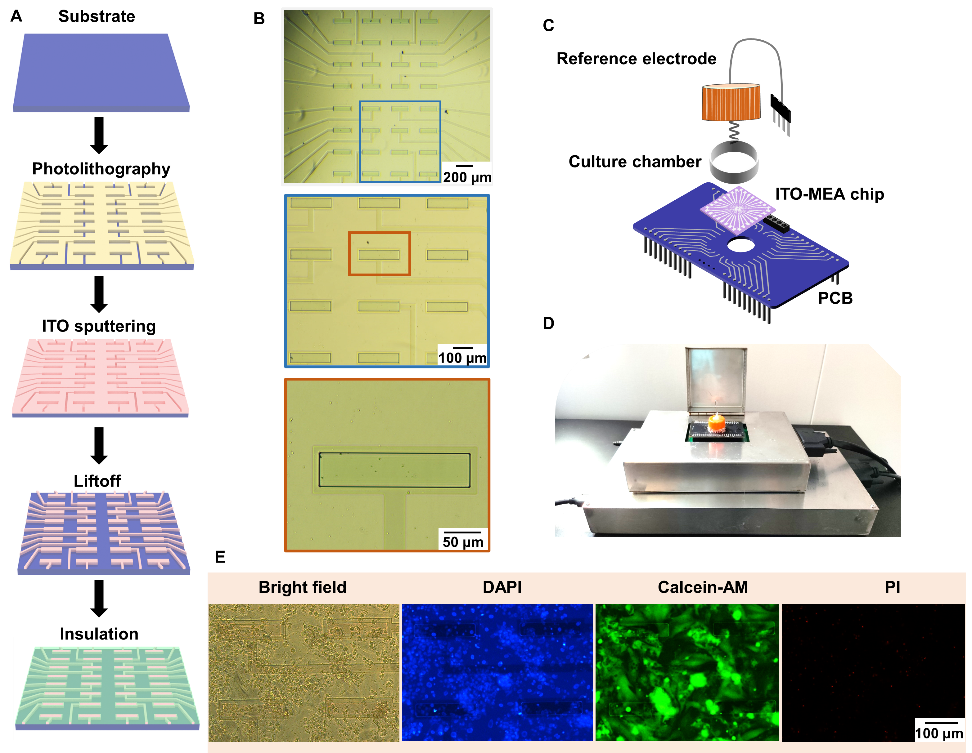
图二. 基于心肌细胞的一体化生物传感平台的建立。
我们将ITO-MEA器件上培养的心肌细胞电穿孔后,利用图像采集处理系统进行图像采集、信息提取和分析。对采集到的图像进行电极定位、图像识别和细胞计算,输出电穿孔性能的评价标准(包括存活率、递送效率和死亡率)。此外,适当的细胞密度是构建生物传感平台的主要因素,以促进心肌细胞与ITO-MEA器件之间的紧密耦合。我们研究了不同密度电穿孔后装置中的心肌细胞状态以及动作电位的变化。在低密度培养的第3天,电极上生长的心肌细胞较少,仅记录到较低的细胞外振幅。电穿孔后几乎没有细胞内记录。以中等密度培养,心肌细胞在装置上分布良好,偶联良好,可记录其胞外/胞内动作电位。在高密度培养下,心肌细胞密集地覆盖在设备上,仅具有细胞外记录。因此,适当的培养密度可以使心肌细胞在单层中生长均匀分布在器件上,有助于进行电穿孔。
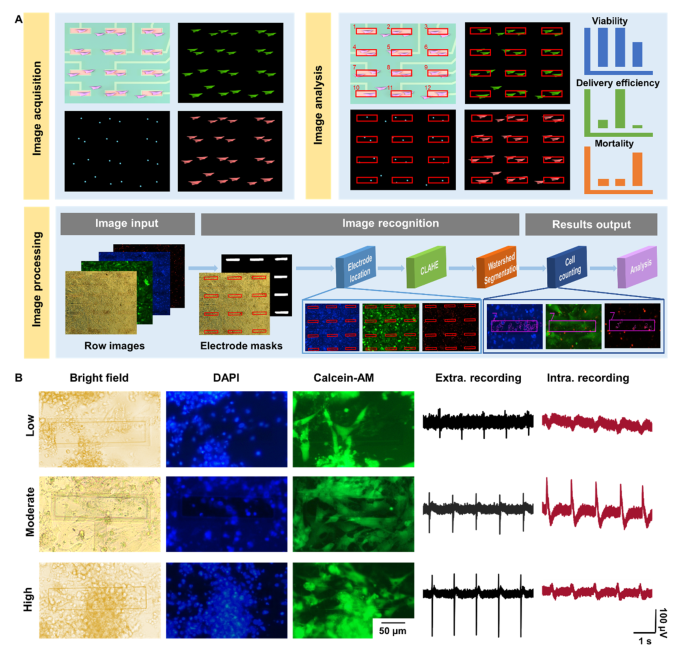
图三. 采集图像分析及生物传感平台优化。
ITO-MEA器件的电极具有传感和刺激功能,可用于记录电穿孔前心肌细胞的自发细胞外记录。通过电穿孔触发,细胞膜上的纳米孔被打开,这为微电极提供了“细胞内通道”,记录从外到内的节律性动作电位。安全的穿孔方法可使细胞保持较高的活力。较高的细胞活力不仅可以保证电生理信号的正常发放和传递,而且有利于药物的递送。电穿孔的关键参数是脉冲幅度,它影响细胞膜上纳米孔形成的概率。为了探索安全的电穿孔和高质量的递送,我们评估了三种不同的电穿孔脉冲幅度(1 V, 3 V和6 V)。在1 V电穿孔条件下,心肌细胞未能成功穿孔,但仍可记录到细胞外动作电位。光学图像显示心肌细胞发出绿色荧光,表明细胞活力良好。通过3v电穿孔成功诱导心肌细胞记录胞内动作电位。由于纳米孔的瞬时生成,PI(溴化丙锭)进入细胞并显示红色荧光,同时保持细胞良好的活力。然而,心肌细胞在6v电穿孔后未能记录到细胞内外动作电位。通过信号分析模块从记录的动作电位中提取振幅、信噪比和放电率,用于电穿孔前后的评估,可以发现在3v电穿孔下,PI可以通过膜上的纳米孔进入细胞内,所有电极可记录到细胞内活动电位。因此,3v电穿孔对于细胞内记录和传递是安全有效的。

图四. 生物传感平台电穿孔触发细胞内记录。
此外,我们将ITO-MEA器件与电穿孔配合,诱导细胞膜上纳米孔的产生,允许细胞外分子通过纳米孔进入细胞内部进行递送。为了评估该生物传感平台的递送性能,我们分析了不同电穿孔脉冲幅度(1 V、3 V、6 V)下ITO-MEA器件上心肌细胞的活力、递送效率和死亡率。通过电穿孔调制将PI递送到细胞中,钙黄绿素AM表征细胞活力,反映了电穿孔的递送效率和安全性。如图五所示,较低的电穿孔电压不能打开细胞膜中的纳米孔。适宜的电穿孔允许细胞膜上的纳米孔开放来执行药物递送。然而,较强的电穿孔会对细胞膜造成不可逆的损伤,导致细胞死亡。而且,我们使用图像采集处理模块来精确评估不同电穿孔条件下的细胞传递,分别计算相应的活细胞、递送细胞和死细胞的数量来评价电穿孔的质量。计算后自动输出细胞活力、递送效率和死亡率,与传统方法相比大大提高了分析效率。实验结果表明了3 V电穿孔可以诱导膜上产生瞬时纳米孔,允许PI进入细胞。因此,细胞内记录的高通量和微创性允许在多个细胞上实现安全、高效地递送。
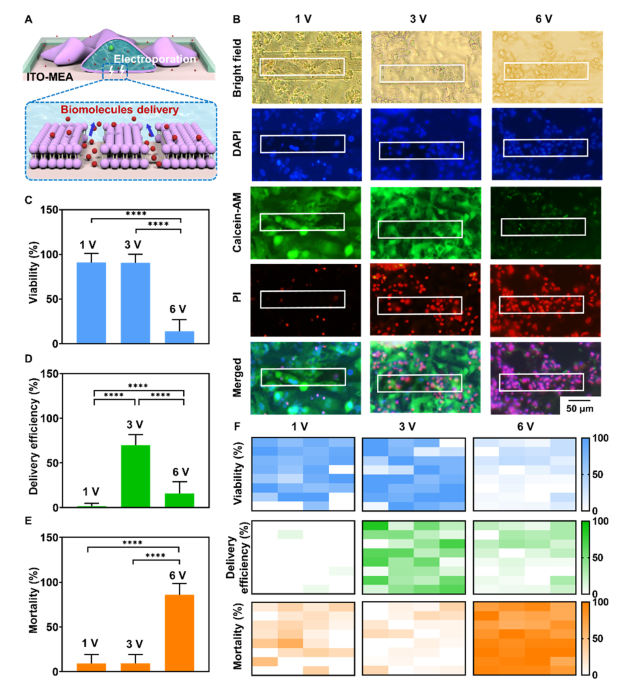
图五. 基于生物传感平台的电穿孔触发递送效率评估。
该研究工作获得国家自然科学基金(62171483, 82061148011,62104264),广东省基础与应用基础研究(2020A1515111210 , 2021A1515011609)和中国科学院开放项目(SKT2006)的资助。
Jiaru Fang, Yuxiang Pan, Jiarong Xu, Dongxin Xu, Hongbo Li*, Chuan Liu*, Ning Hu*, Integrated cardiomyocyte-based biosensing platform for electroporation-triggered intracellular recording in parallel with delivery efficiency evaluation, Nano Letters, 2023, 23(9), 4049-4057.
论文链接:https://pubs.acs.org/10.1021/acs.nanolett.3c00917